177-5119-4211
相关推荐
ISO13485认证简介
国际标准化组织(ISO)制定了涵盖多个领域的超过17,000个国际标准,对于医疗器械组织而言,这些标准中最为重要的就是ISO13485,它提供了国际公认的、与医疗器械行业有关质量管理体系(QMS)的最佳实践。
ISO13485全称是《医疗器械-质量管理体系-用于法规的要求》,该标准由ISO/TC210-医疗器械质量管理和通用要求标准化技术委员会制定,贯穿产品立项、设计开发、样品制备、注册检测、临床试验、产品注册、生产、销售、使用等医疗器械全生命周期的每个环节。符合ISO13485,使生产商能够清楚地表明其有能力提供持续满足顾客要求和适用法规要求的医疗器械产品,为消费者和专业人士提供信心。
ISO13485医疗器械质量管理体系认证,是医疗器械符合多数国家相关法规要求的重要基础,也是你承诺满足客户要求的体现。但就多数国家而言,医疗器械制造商仅仅符合ISO13485标准并不足以符合所有法规要求,他们同时需要法规授权机构签发相应的法规认证证书。而对于医疗器械分包商、零部件制造商、服务提供商及医疗器械经销商来说,通常只需要获得ISO13485证书。
无论是对于品牌持有者、小型制造商,还是跨国企业,医疗器械认证均同样适用。
通过ISO 13485认证,保持体系合规
ISO 13485标准是满足QMS综合要求的有效解决方案。通过ISO 13485认证,为制造商满足医疗器械指令、法规和对产品安全和质量的承诺提供了实践基础。
ISO 13485认证的优势
ISO 13485认证可以帮助您提高整体质量体系水平,消除不确定性并扩大市场机会。获得此认证是组织对客户和监管机构的质量承诺。
- 概述如何评估和改进流程
- 提高效率、削减成本并监控绩效
- 证明您生产安全的医疗器械
- 符合法规要求和客户期望
ISO 13485:2016 已成为欧盟协调标准
医疗器械质量管理体系标准ISO 13485:2016已成为欧盟医疗器械指令:MDD,AIMDD和IVDD的协调标准。欧盟官方公报(EU Official Journal)已公布EN ISO 13485:2016正式取代上一版EN ISO 13485:2012。EN ISO 13485:2012的 “推定符合的截止日期(cessation of presumption of conformity)”为2019年3月31日。
欧盟协调性标准是应欧盟委员会的要求,由认可的欧盟标准组织(CEN / CENELEC / ETSI)开发的标准,标准以“EN”开头。协调性标准虽为自愿性标准,却是欧盟最认可的标准(State of the art)。选择欧盟协调标准,是证实符合欧盟法规最好的途径和方法。
EN ISO 13485:2016协调标准的发布,进一步推进了标准与MDR法规 和IVDR法规间的融合,使得制造商能够将符合标准,作为满足相关法规要求的证据。MDR和IVDR的转版期分别为3年和5年。
提供ISO 13485及CE认证服务
ISO 13485是医疗器械组织证明其符合医疗器械行业法律法规的最佳的国际公认模型。 ISO 13485作为质量管理体系标准,是欧盟医疗器械指令和法规下CE认证的基础。
尽管根据欧盟医疗器械指令和法规,ISO 13485认证不是CE认证的直接要求,但已被欧盟委员会确认为协调标准。作为提供CE认证的领先公告机构之一,我们可为您选择最有效的合格评定途径进行CE认证。
ISO13485认证流程
一、具体内容
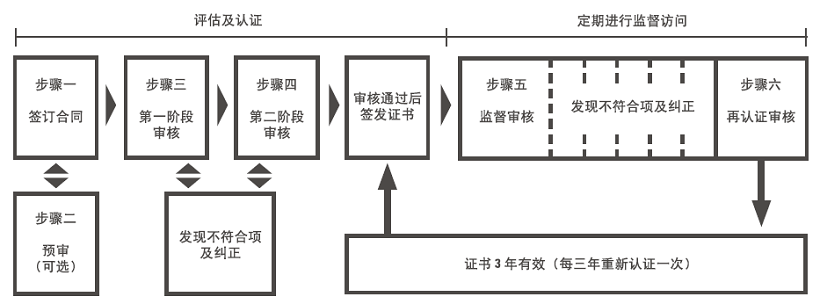
![]() 步骤1 - 根据组织的规模和业务类型提供定制化的建议,在您签署合同书后,咨询工作即可开始。
步骤1 - 根据组织的规模和业务类型提供定制化的建议,在您签署合同书后,咨询工作即可开始。
![]() 步骤2 - 提供可选择的,针对准备情况与薄弱环节的“预审”服务。
步骤2 - 提供可选择的,针对准备情况与薄弱环节的“预审”服务。
![]() 步骤3 - 正式审核。第一阶段:准备情况评估:对组织建立的文件化体系及其他重要体系进行评估,提出不符合项。
步骤3 - 正式审核。第一阶段:准备情况评估:对组织建立的文件化体系及其他重要体系进行评估,提出不符合项。
![]() 步骤4 - 第二阶段:包括与工作人员面谈、文件记录的检查以及对工作实践的现场考察,提出审核发现。审核合格后会签发证书。
步骤4 - 第二阶段:包括与工作人员面谈、文件记录的检查以及对工作实践的现场考察,提出审核发现。审核合格后会签发证书。
![]() 步骤5 - 根据合同,每半年或一年对体系和整改计划的实施进行监督审核。
步骤5 - 根据合同,每半年或一年对体系和整改计划的实施进行监督审核。
![]() 步骤6 - 证书签发3年期满后,实施再认证审核。
步骤6 - 证书签发3年期满后,实施再认证审核。
二、图示
选择中质捷进行ISO 13485认证
我们的业务人员可帮助您和贵组织理解评估和认证过程的每个阶段,确保您完全理解ISO 13485过程及其可用的指南。我们提供的培训课程可帮您全面了解遵守标准的复杂性,以及该标准应对的法律和法规。
ISO13485认证相关服务
1、ISO13485内审员培训
2、欧盟CE认证及检测项目
3、美国FDA注册和检测项目
ISO13485体系认证的费用核算需要了解企业的人数、产品、以及审核机构等事宜,如需了解详细报价,可咨询在线客服或者致电与我们的专业咨询师联系,我们会为您做详细解答
项目概述






















































